top of page
UNIDAD 3

MENÚ
COMPUESTO IÓNICOS
Al enlace iónico lo representan las sales, tanto binarias como de orden superior, y ciertos óxidos e hidróxidos, principalmente de elementos metálicos

Cada átomo de sodio cede un electrón al átomo de cloro. Este se convierte en un ion con carga negativa, mientras se forma el ion sodio con una carga positiva
Índice de coordinación
Los distintos compuestos iónicos adoptan diferentes estructuras cristalinas características en las que los iones se colocan de forma peculiar en los nudos de la red
Condiciones para estructuras cristalinas
El empaquetamiento debe ser máximo: los iones deben ocupar el menor volumen posible.
Geometría de red de cloruro de sodio
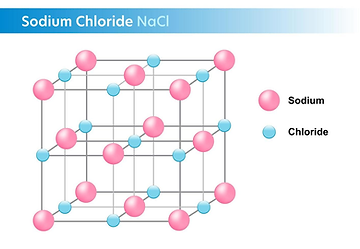
El cristal debe ser neutro: el número de cargas positivas ha de ser igual al de cargas negativas.
Número de coordinación
Es el número de iones de signo contrario que le rodean a la misma distancia dentro de una red cristalina.
Los elementos metálicos, situados a la izquierda y en el centro de la tabla periódica, tienden a perder electrones para formar iones positivos o cationes.
Los elementos no metálicos, situados a la derecha de la tabla periódica, tienden a ganar electrones para formar iones negativos o aniones
Este tipo de enlace se produce cuando se combinan los metales con los no metales.
Propiedades de las sustancias iónicas
A temperatura ambiente son sólidos de elevado punto de fusión.
Son solubles en agua.
En disoluciones acuosas o fundidas conducen corriente eléctrica, pero no en estado sólido.
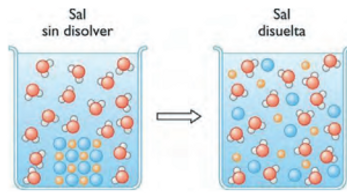
la sal en sí no puede conducir electricidad, pero si la diluimos en agua se separa en sus iones y puede conducir corriente eléctrica como se muestra en la imagen.
¡JUEGO!
bottom of page

